靶向药——精准医疗时代的产物
- 2019-06-21
- 来源:长城产业洞见
“根据国家癌症中心2018年最新统计数据,2015年恶性肿瘤发病约392.9万人,死亡约233.8万人,平均每天超过1万人被确诊为癌症,每分钟有7.5个人被确诊为癌症,且与历史数据相比,癌症费用呈持续上升态势。面对持续上升的癌症费用,自研靶向药是癌症患者的出路更是生路。”
靶向药(精准药物设计)是生物技术和信息技术发展融合的产物。药学、分子生物学和生物信息学等学科的快速进步,推动人类基因组计划的完成,后基因组时代功能基因组的迅猛发展,有力地推动了靶标的确证及结构生物学发展,并促进了基于靶标三维结构的精准药物设计。1997年11月,利妥昔单抗(抗CD20单克隆抗体),获准治疗肿瘤的第一个单克隆抗体靶向药物。2001年10月,甲磺酸伊马替尼(酪氨酸激酶抑制剂),获准治疗肿瘤的第一个小分子靶向药物。
靶向药物可作用于特定病变部位,减少对正常组织、细胞的伤害,主要用于癌症治疗。靶向药物是指为了使药物或其载体能瞄准特定的病变部位,并在目标部位蓄积或释放有效成分,通过技术手段赋予靶向能力的药物或其制剂,目前主要用于治疗癌症。由于靶向药物可在目标局部形成相对较高的浓度,所以在提高药效的同时抑制毒副作用,减少对正常组织、细胞的伤害。根据不同靶向机理可将靶向药物分为被动靶向、主动靶向、物理靶向三类。根据不同标靶层次可将靶向药分为组织器官水平、细胞水平及亚细胞水平三类。

图1-1 靶向药分类
靶向药产业链上游是基于结构生物学的设计研发,中游为需要特殊工艺的生产制造环节,下游是销售与临床应用。由于靶向药研究技术难度较高,形成较高的进入壁垒,未形成充分竞争的市场格局。2018年全球癌症类药物销售额排名前15的药品中仅一种为非靶向药,且大部分由美国企业研制 。
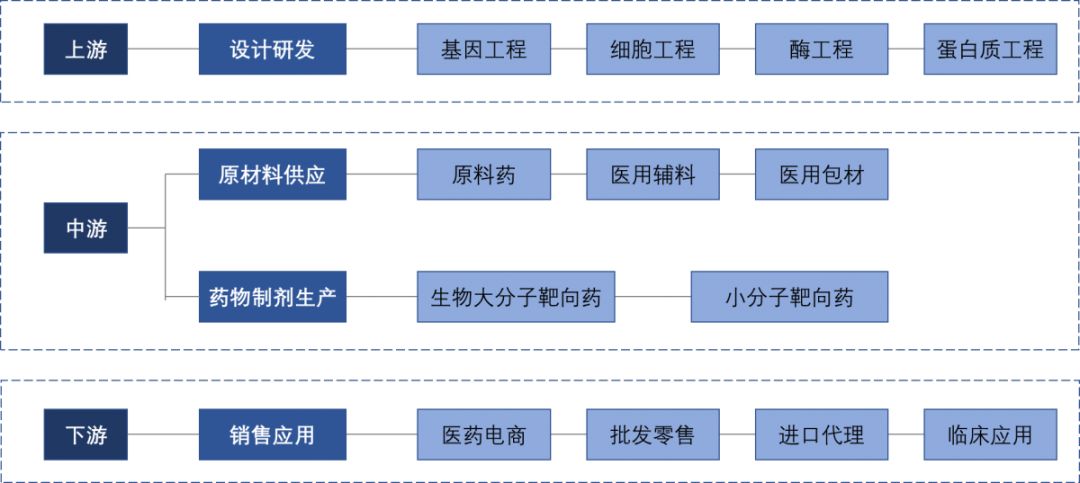
图2-1 靶向药产业链

图2-2 2018年全球癌症药物销售额排名前15的药物情况
数据来源:药渡,GEI整理
我国靶向药研发起步较晚,目前以仿制为主。2005年由阿斯利康研发的吉非替尼成为首个进入中国市场的靶向药。2011年由贝达药业研发的埃克替尼获批,成为中国首个拥有自主知识产权的小分子靶向抗癌药。2018年由和记黄埔医药自主研制的呋喹替尼上市,该药是我国首个从研发到新药上市申请都在国内完成的主流抗癌新药。以贝达药业、恒瑞医药、正大天晴等为代表的靶向药企业集中分布于江苏、上海等地。靶向药研制主要依托东南沿海的大型药企。

图2-3我国部分靶向药企业分布情况
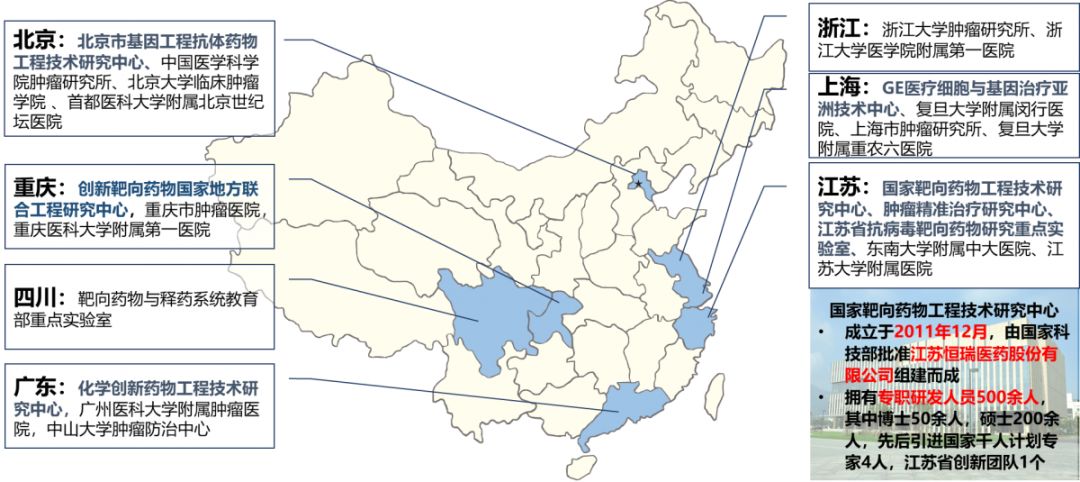
图2-4我国部分靶向药科研单位分布情况
我国癌症相关支出持续上升,靶向药市场需求持续增加。根据IMS统计数据,2018年我国用于癌症治疗及相关辅助治疗的费用将近90亿美元,其中治疗支出63亿美元,较2017年增长23.6%。2018年全球用于治疗癌症晚期的分子药物共849种,其中约91%为靶向药物,相较于2017年,生物靶向药增长约30%,小分子靶向药增长约14%。综合来看,我国靶向药物未来市场发展空间仍较大。

图3-1 2014-2018年我国癌症费用支出情况
数据来源:IMS,GEI整理
国家政策推动,提升靶向药可及性。2018年国家通过发布抗癌药降税目录并开展抗癌药医保准入专项谈判等手段,增加临床急需肿瘤药可及性,有利于癌症靶向药物研发生产企业解决由于用药费用高昂带来市场销售不畅这一不利因素。2018年发布的《关于抗癌药品增值税政策的通知》明确对第一批共51种抗癌药品减征关税,其中18种自费肿瘤药中,用药金额较高的小分子靶向药物数量占11种。
我国靶向药产业发展呈现专业化医药外包、与信息技术高度融合、化学小分子靶向仿制药为研发方向的三大趋势。面对靶向药研发成本高且国内融资渠道少的问题,专业化医药研发外包和医药生产外包成为国内发展趋势。生物芯片、云计算等信息技术将进一步促进靶向药物设计技术发展,并显著缩短确证时间。靶向药是个性化治疗的物质基础,同时个性化治疗从需求侧推动靶向药发展,可及性更高的化学小分子仿制靶向药将是我国短期靶向药研发重点。
我国靶向药发展面临研发成本高、政策风险高、创新药专利水平低三大问题。由于靶向药研发费用高、时间长导致研发成本高,且国内融资渠道少导致小型新兴药企难以维持。由于用药成本过高,导致靶向药依赖医保、降税等政策提高药物可及性。上市、并购等市场融资渠道受政策影响大,我国虽在尚未盈利的生物医药企业上市政策方面有重大突破,但后续监管等配套政策力度尚不明朗,存在风险。目前,与发达国家相比,我国专利药市场份额偏低,中美贸易摩擦背景下易受美方技术制约。
我国靶向药产业虽起步较晚,且面临研发成本高、政策风险高、创新药专利水平低三大问题,但未来市场需求持续走高、市场发展空间大,且随着医保谈判、降税减费等政策提高靶向药可及性,靶向药竞争格局生变。






合计: {{price}} 元 (不含运费)
去购物车结算